基礎研究について
基礎研究について
腸班では、様々な側面から大腸癌及び手術治療についてマウスを用いた基礎研究を行っております。現在は主に3つの研究班に分かれており、肥満と発癌・癒着形成をテーマとしたグループ(岡林)、炎症と転移(鶴田・茂田)・腫瘍微小環境と腫瘍免疫をテーマとしたグループ(茂田)、がん幹細胞をテーマとしたグループ(清島)があります。
下記に腸班から学会や論文とした発表した研究の一部を取り上げます。
肥満と発癌
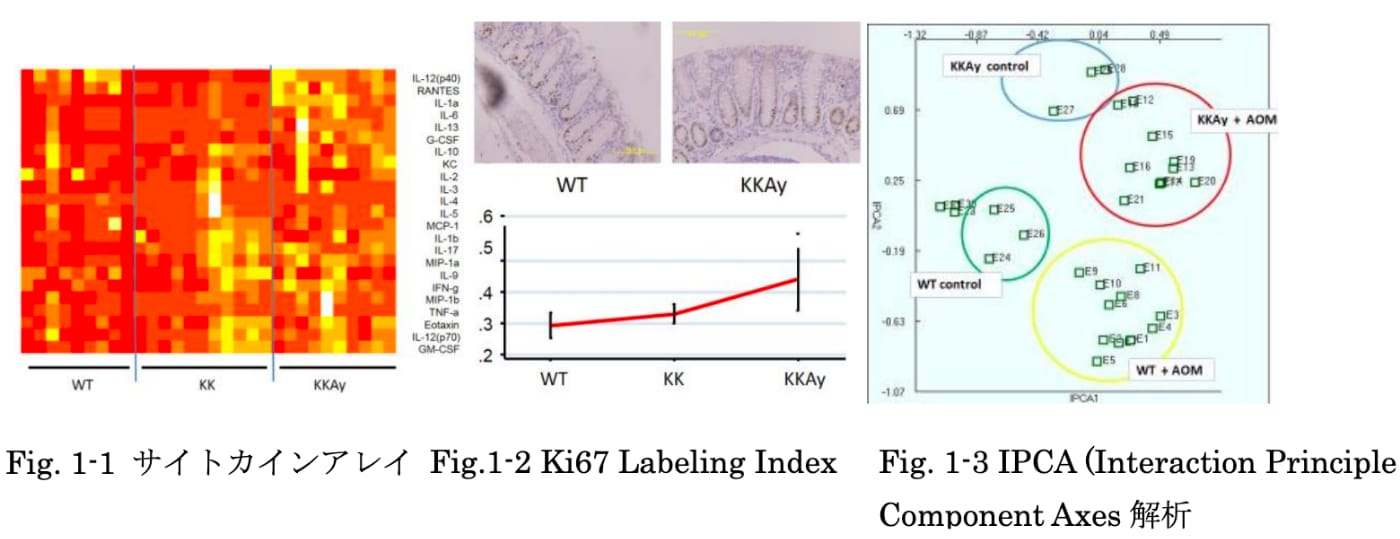
われわれは、肥満マウスにAOMを投与し、大腸癌を化学発生させるモデルを用い、炎症性サイトカインと腸内細菌の観点から肥満と発癌に関与するメカニズムの検討を行いました。まず、肥満マウスでは有意に腺腫の発生が増加し、肥満マウスの大腸粘膜では Ki-67の発現が亢進し、BrdU の取り込みが増加することを確認しました。
サイトカインアレイでは、肥満マウスのIL-13分泌が亢進しており、その大腸粘膜におけるレセプターの過剰発現を認めました。また、オルガノイドに IL-13を添加すると絨毛形成が亢進し、IL-13が肥満関連大腸癌の1つの要因となることを示しました。また腸内細菌の検討では、両郡間に特徴的な分布の差が見られ、腫瘍発現群はコントロール群に比べ、乳酸菌群、酪酸産生菌群、およびAkkermansia muciniphilaが少ない傾向を示しました。今後はさらに抗菌薬などによる腸内細菌叢の変化が、肥満マウスの発癌にどのような影響を与えるかなどさらなる検討を行う予定です。
出典
Matsui S, Okabayashi K et al. Interleukin-13 and its signaling pathway is associated with obesity-related colorectal tumorigenesis. Cancer Sci. 2019;110(7):2156–2165.
炎症
(潰瘍性大腸炎における新規増悪因子surfactant protein Dについての検討)
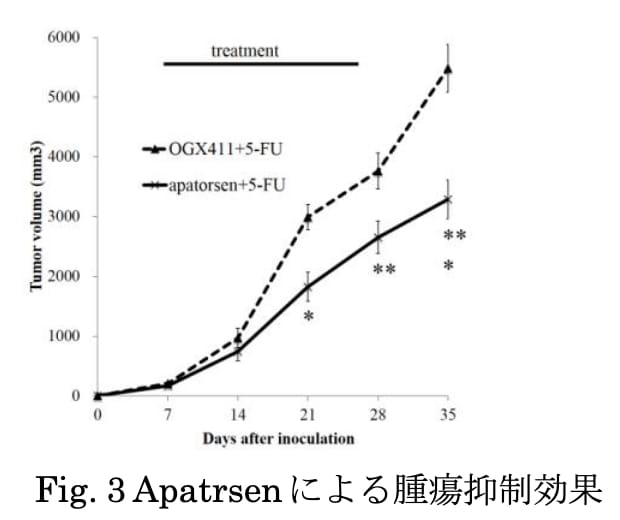
難治疾患である潰瘍性大腸炎(UC)の発症にはいくつかの遺伝子異常の関連が示唆されています。われわれは、surfactant protein D(SP-D)をコードするSFTPD遺伝子の一塩基多型がUC患者に多いという過去の網羅的解析の結果から、UCとSP-Dの関連について検討しました。具体的には、デキストラン硫酸ナトリウム溶液(DSS)による大腸炎モデルマウス(DSS群)を作成し、その血中SP-Dレベルを計測したところ、コントロール群(control群)と比較し有意に高いことを明らかにしました(p=0.02)。また、SP-Dノックアウトマウスを用いてDSSによる大腸炎モデルを作成したところ(SP-D-KO DSS群)、通常マウスによるDSS群と比較し、大腸炎の臨床的および肉眼的重症度スコアは有意に低く(p<0.01)、また、大腸におけるMPO活性やIL-6も、低い傾向を認めました(ともにp=0.08)。今後さらに、臨床検体などでの検討も追加していく予定です。
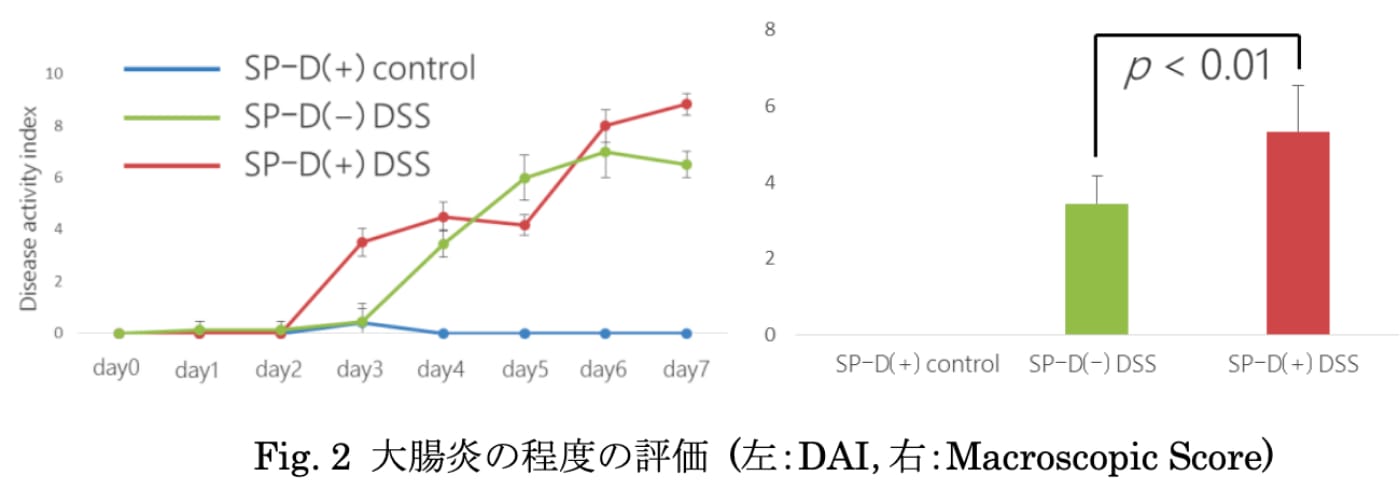
Hsp27を標的とするapatorsenによる新規治療の開発
抗癌剤耐性(HSP27を標的とした、大腸癌に対する新規治療法の開発)Heat Shock Protein(Hsp)27は、低分子のシャペロン蛋白質で、種々のストレスに対応し産生され細胞を防御する機能を有しています。このHsp27に対するアンチセンスオリゴヌクレオチドであるapatorsenは膀胱癌や前立腺癌において抗腫瘍効果が報告されています。そこで我々は、これまでの実験結果を踏まえ、apatorsenによるHSP27抑制が大腸癌に対する5-FUの感受性を増強することを明らかにしました。具体的には、ヒト大腸癌細胞株SW480に、apatorsenを48時間暴露すると、濃度依存性にHsp27レベルは抑制され(p=0.03)、5-FUに対する感受性も増強されました。また、SCIDマウスを用いた腫瘍片皮下移植モデルでの検討においても、コントロール群と比較し、Apatorsen群は5-FUによる抗腫瘍効果が有意に増強されました。つまり、大腸癌化学療法において、Hsp27を標的とするapatorsenによる新規治療は非常に有望と考えられ、現在更なる機能解析を行っています。
出典
Shimada T, Tsuruta M et al. Heat shock protein 27 knockdown using nucleotide‑based therapies enhances sensitivity to 5-FU chemotherapy in SW480 human colon cancer cells. Oncol Rep. 2018;39(3):1119–1124.
癒着形成
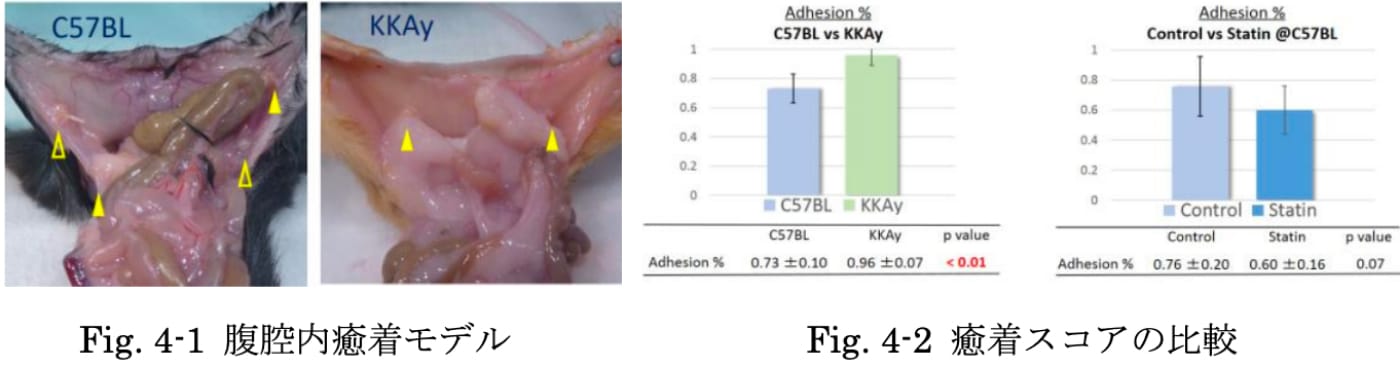
肥満は癒着を促進し、スタチンは癒着を低減するという報告があり、肥満と癒着の関係に注目が集まっています。われわれはischemic buttons modelという腹膜の局所的な虚血部位を作成する方法で、術後腹腔内癒着を人工的に形成する方法を確立し、癒着の定量的評価を行うことに成功しました。術後7日目の癒着形成頻度は、野生型マウスで73±10(%)、肥満マウスで96±7(%)であり、肥満型で有意に癒着形成頻度が多いという結果を得ました(p<0.01)。次に、スタチン投与を行ったところ、癒着形成頻度はスタチン投与群60±16(%)、対照群76±20(%)であり、癒着軽減の傾向を認めました(p=0.07)。
大腸癌肝転移における線維化肝の幹細胞ニッチとしての役割に関する研究
過去の研究で線維化肝患者は正常肝患者と比較して大腸癌肝転移再発率が高いことが示されています。大腸癌の肝転移にはLgr5というWntシグナルの標的遺伝子を発現している細胞が重要な役割を果たしていることが分かっており、この細胞からすべての腸の細胞が分化します。Lgr5陽性の大腸癌細胞はcancer initiating cell(あるいは「がん幹細胞」)と呼ばれ、幹細胞としての役割を有しています。Lgr5陽性癌細胞がこの働きを維持するためには、ニッチという周囲の微小環境が重要な役割を果たしているとされており、様々な細胞が様々な物質を介してWntシグナルを活性化し、細胞の増殖、分化などを促進しています。
線維化肝はニッチとして何らかの役割を有していると考えられ、これに関連する細胞や物質の同定が癌転移のメカニズム解明や転移の抑制につながることが期待されます。
当教室では肝線維化モデルマウスの作成手法を確立しております。マウスの門脈に腫瘍細胞を注射することで肝転移を起こし、肝線維化モデルマウスと正常マウスでの転移個数や転移様式を比較し、関連する細胞や物質の同定に向けて研究を行っております。
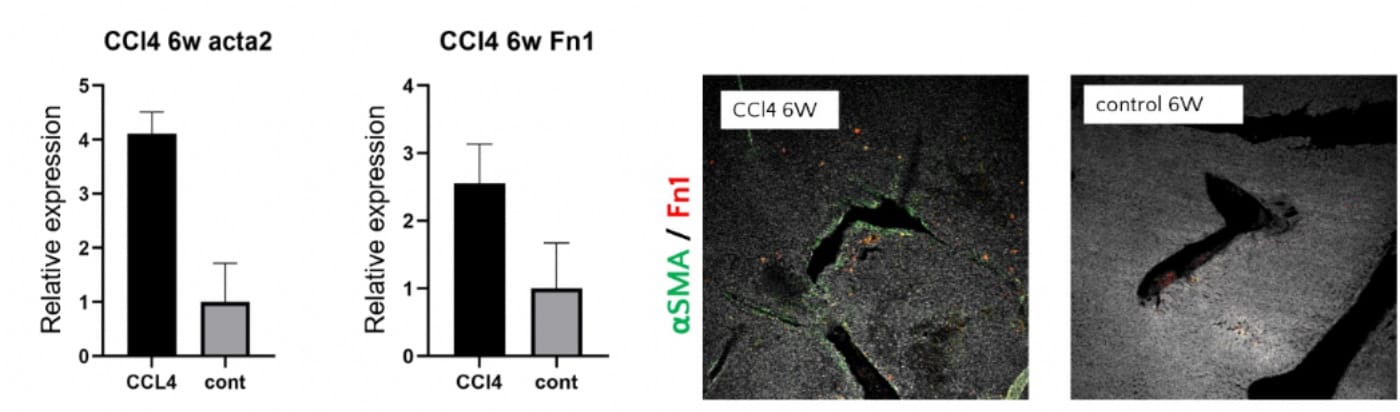
腫瘍微小環境の改善による腫瘍免疫活性化の検討
癌の微小環境は、劣悪な低酸素状態・代謝環境、マトリックスの再構築とそれに伴い増大した組織、劣化した免疫応答による慢性炎症状態などを特徴とし、治療抵抗性の主な要因の1つであると考えられております。慢性炎症を背景として発癌することも多いため、このような腫瘍微小環境を正常化し、抗腫瘍治療効果を増大させることができれば、今後の癌治療のさらなる向上につながると期待されます。当教室では、確立された動物モデルを使用し、腫瘍細胞を直接動物の臓器に打ち込むことで、実際に生じる現象と近似した状態を再現させております。腫瘍細胞-免疫細胞間の相互作用の評価解析を行ない、腫瘍免疫を活性化するための機序について研究を行ってきました。各種治療薬を併用させ、どのような変化が起きているのかについて観察を加え、腫瘍環境の低酸素化、線維化、血管の状態を評価し、さらにそれらを改善させる治療について研究を続けております。上記内容に関しては国内外の学術集会や論文投稿しており、今後の治療の一助となると考えております。
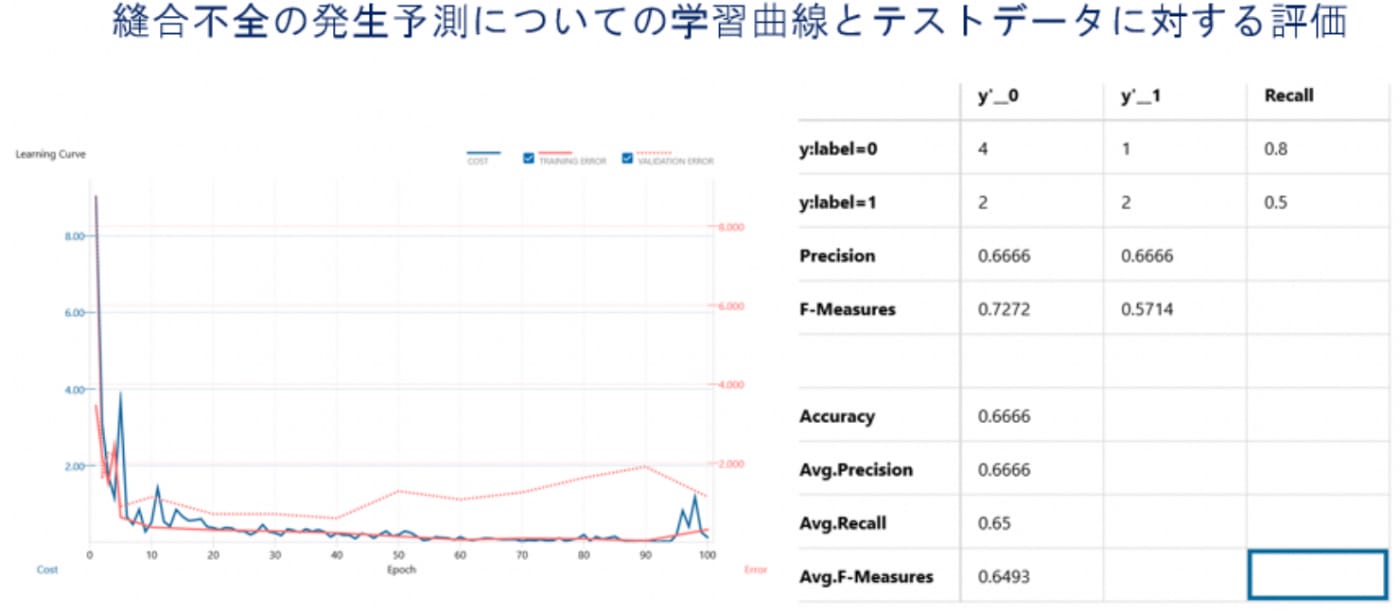
人工知能を用いた画像解析についての研究
近年、人工知能(artificial intelligence;AI)を用いた画像解析についての研究が広く行われており、徐々に臨床への応用が試みられております。当教室でもこれらの研究に取り組んでおり、特に腹腔鏡手術などの術中画像から予後や合併症発生についての予測する試みを行っております。例えば Double Stapling Technique(DST)を用いた吻合の術中2D画像に対してAIによる画像解析を行い、術後縫合不全の発生を予測するモデル作成を行いました.このモデルでは正診率は縫合不全あり、なしいずれも66.7%、平均適合率は66.7%、平均再現率65%、F-measure 0.649といずれもある程度正しく術後縫合不全の発生を予測することが可能でした。
今後は術前画像や患者背景と術中画像を組み合わせた解析など、さまざまなアイデアをもとにこれらの研究に取り組み,臨床への応用を目指してまいります。
Copyright© 慶應義塾大学医学部外科(一般・消化器外科)腸班.
All rights reserved.

